Quando falamos em pH, fazemos referência ao potencial hidrogeniônico de uma solução, ou seja, a quantidade de cátions hidrônio (H+ ou H3O+) que estão dispersos no solvente de uma solução.
Os cátions hidrônio são muito conhecidos por causa da definição proposta pelo cientista Arhenius para um ácido. Esse cientista afirma que ácido é toda substância capaz de se ionizar e produzir íons hidrônio em meio aquoso.
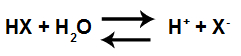
Equação da ionização de um ácido
A sigla pH serve como referência para a determinação do nível de acidez de um meio. Porém, há muito tempo, os químicos também utilizam o pH como referência para determinar, além da acidez, se um meio é básico ou neutro.
Isso é possível porque os químicos passaram a ter conhecimento de que a água sofre autoionização, ou seja, produz hidrônios (H+) e hidróxidos (OH-). Assim, uma solução aquosa nunca apresenta apenas hidrônio ou hidróxido, mas os dois, como podemos observar a partir da equação a seguir:
Equação da autoionização da água
Valores utilizados como referência para o pH
Os valores utilizados para o pH têm como referência a constante de ionização (Kw) da água na temperatura de 25oC, que é a igual a 10-14. Nessa temperatura, as concentrações dos íons hidrônio e hidróxido produzidos pela água são absolutamente iguais, ou seja, 10-7 mol/L.
[H+]=[OH-]= 10-7
A partir dessa referência, os valores utilizados para o pH variam de 0 até 14.
Fórmulas para o cálculo do pH
a) Cálculo a partir da concentração em mol/L de cátions hidrônio
O cálculo do valor do pH pode ser realizado de forma direta, desde que conheçamos a concentração de hidrônios ([H+]). Veja:
pH = -log[H+]
ou
10-pH = [H+]
b) Cálculo a partir da concentração de ânions hidróxido (OH-)
pOH = -log[OH-]
ou
10-pOH = [OH-]
Após calcular o valor do pOH, é necessário utilizá-lo na expressão a seguir para determinar o valor do pH.
pH + pOH = 14
Interpretação dos valores do pH
Conhecendo o valor do pH, podemos determinar se a solução em questão tem caráter ácido, básico ou neutro. Para isso, basta utilizar a seguinte relação esquemática:
- Para valores de pH inferiores a 7 = meio ácido;
- Para pH com valor igual a 7 = meio neutro;
- Para valores de pH superiores a 7 = meio básico.
Exemplos
1º Exemplo: Sabendo que a concentração de cátions hidrônio de uma solução vale 2.10-4 mol/L, qual deve ser o valor do pH dessa solução?
Para determinar o valor do pH da solução a partir da concentração de hidrônios (H+), 2.10-4mol/L, devemos utilizar a seguinte expressão:
pH = –log[H+]
pH = –log[2.10-4 ]
pH = –(log 2 + log 10-4)
pH = –log2 – log10-4
pH = –log 2 – 4.log 10
pH = –0,3 + 4.(1)
pH = –0,3 + 4
pH = 3,7
2º Exemplo: Uma solução formada por um determinado soluto apresenta concentração de íons hidróxido igual a 10-11 mol/L. A partir dessa concentração, podemos afirmar que o pH dessa solução vale quanto?
Para determinar o valor do pH da solução a partir da concentração de hidróxidos, 10-11 mol/L, devemos fazer o seguinte:
1o Passo: calcular o valor do pOH.
10-pOH = [OH-]
10-pOH = 10-11
Devemos multiplicar a expressão por -1 porque o pOH sempre é uma incógnita positiva.
-pOH = -11.(-1)
pOH = 11
2o Passo: calcular o valor do pH.
pH + pOH = 14
pH + 11 = 14
pH = 14 – 11
pH = 3
Diogo Lopes Dias

Nenhum comentário:
Postar um comentário